Metavectum Tumor Test
Opgericht in juli 2008, bevindt Metavectum zich als een onafhankelijk bedrijf op het terrein van het DESY (Deutsches Elektronen-Synchrotron), een belangrijk onderzoeksinstituut van de Bondsrepubliek Duitsland. De belangrijkste activiteiten van Metavectum zijn humane medische moleculaire analyse en de synthese van ultra zuivere stoffen voor gebruik in de complementaire geneeskunde. De zakelijke relatie en alle diensten van Metavectum zullen zoals gebruikelijk worden voortgezet door iQMedix GmbH, Notkestr. 85 Geb. 3, 22607 Hamburg, Duitsland, vanaf 1 augustus 2023.
In het team van iQMedix werken moleculair biologen en biochemici samen met laboratoriumartsen.
Analyse en validatie van assays en reagentia zijn in overeenstemming met de richtlijnen van de federale medische vereniging (Bundesärztekammer, Rili-BÄK) en de internationale MIQE-normen. Apparatuur die wordt gebruikt in de bio moleculaire analyse is CE-gecertificeerd.
iQMedix maakt deel uit van een netwerk van oncologen, chirurgen, radiologen, pathologen, gespecialiseerde artsen en gespecialiseerde klinieken, om ervoor te zorgen dat directe implementatie van de resultaten mogelijk is.
Het bedrijfsmodel omvat de volgende gebieden:
· Metavectum Preventietest
· Metavectum Tumortest
Metavectum Preventietest
Met de Metavectum Preventietest wordt een verzwakking, storing of ziekte in een vroeg stadium gediagnosticeerd door middel van een nieuwe array-analyse van het algehele metabolisme. Uit de resultaten wordt een therapiesuggestie afgeleid en aan de arts voorgelegd. Afwijkingen in het metabolisme die tot ziekte kunnen leiden, worden in een zeer vroeg stadium gedetecteerd, zodat passende maatregelen kunnen worden genomen.
De test wordt ook gebruikt tijdens en na de tumortherapie om informatie te verkrijgen over het begin van metabole veranderingen die wijzen op een recidief of een vroege indicatie van een metabole verschuiving naar cachexie, bijvoorbeeld.
Voor analytische doeleinden is apparatuur beschikbaar die normaal gesproken alleen in grotere farmaceutische bedrijven te vinden is (600 MHz NMR gekoppeld aan massaspectrometer en HPLC). Deze gegevens op het niveau van lage moleculen (metaboloom) worden gecombineerd met gegevens van de niveaus van genexpressies (transcriptoom) en eiwitten (proteoom) om een gedetailleerd beeld te geven van het algehele metabolisme.
Metavectum Tumortest
Tumoren en metastasen ontwikkelen een zeer individueel profiel, dat varieert van persoon tot persoon. Daarom moet ook de behandeling van de tumor worden geïndividualiseerd en moet de verscheidenheid aan therapeutische methoden (radiotherapie, chirurgie, chemotherapie, complementaire therapieën, immunotherapie, enz.) in onderlinge samenwerking worden gebruikt.
De Metavectum Tumortest wordt gebruikt om de individuele metabolische activiteit van tumor specifieke receptoren en eiwitten (“Achilleshiel” van de tumor) op het niveau van genexpressies in het transcriptoom en genmutaties in het genoom te bepalen. De analyses worden uitgevoerd op schriftelijk verzoek van de behandelend arts, en uit de resultaten wordt een therapiesuggestie afgeleid en aan de arts voorgelegd. Het testsysteem bepaalt de optimale geneesmiddelen voor elke patiënt uit het totale aantal goedgekeurde tumorgeneesmiddelen
Zowel genexpressie- als gen mutatiegegevens worden in de test gecorreleerd. De reden hiervoor is dat momenteel, afhankelijk van de tumor, slechts ongeveer 2-35% van alle tumoren klinisch relevante mutaties vertonen die geneesmiddelremming van overeenkomstige receptoren mogelijk maken.
Er moet worden opgemerkt dat de kweek van tumorcellen en de incubatie van de cellen met verschillende geneesmiddelen als bewijs van effect niet wordt uitgevoerd, de procedure levert geen reproduceerbare resultaten op. De hier gebruikte methode is uitsluitend gebaseerd op de evaluatie van relevante genexpressie op basis van mRNA en de bepaling van klinisch relevante mutaties. DNA of mRNA wordt geëxtraheerd uit de geïsoleerde tumorcellen.
Aan de ene kant wordt geëxcideerd weefsel gebruikt als testmateriaal, dat na schriftelijke toestemming van de patiënt door de chirurg/oncoloog naar iQMedix wordt gestuurd op droogijs (-80 ºC) of in paraffine. Aangezien tumorbiopsieën gemiddeld slechts 10-20% puur tumorweefsel bevatten, naast bindweefsel en precancereus weefsel, worden de monsters eerst naar de patholoog (in dit geval Pathologie Grandweg, Hamburg) gestuurd. De patholoog beschrijft het type en de status van de tumor en geeft de exacte locatie in het weefsel aan. Op basis van het pathologisch rapport worden de tumorcellen geïsoleerd uit de biopsie bij iQMedix en onderzocht. Parallel of als mono-analyse worden circulerende tumorcellen (CTC’s) geïsoleerd uit het volledige bloed van de patiënt (“vloeibare biopsie”). CTC’s vormen de schakel tussen de primaire tumor en metastasen en geven informatie over welke therapeutische middelen kunnen worden gebruikt om de metastasen te behandelen.
De analyse van ten minste 10 tumormarkers zorgt ervoor dat de geïsoleerde cellen inderdaad circulerende tumorcellen zijn en geen endotheel- of epitheelcellen die continu in de bloedbaan worden vrijgegeven door organen of het vaatstelsel en valse positieven van circulerende tumorcellen in grote aantallen veinzen.
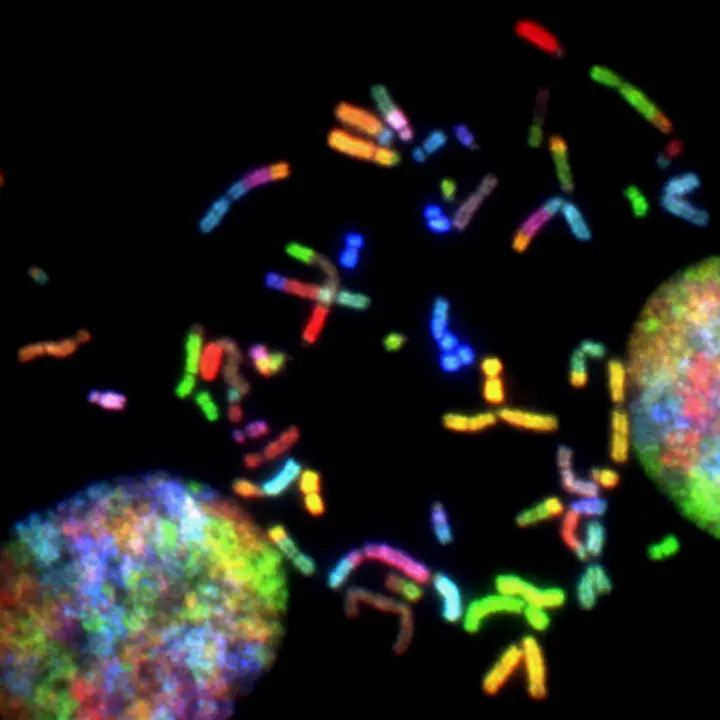
Normaal gesproken worden tussen de 5 en 120 CTC’s gevonden in één milliliter bloed. DNA en mRNA worden nu geëxtraheerd uit de tumorbiopsie en de CTC’s. Met behulp van real-time PCR (qPCR) worden de expressies van tumorrelevante genen in het transcriptoom gekwantificeerd in het tumor-RNA (biopsie) en vergeleken met de overeenkomstige expressies van de circulerende tumorcellen (vloeibare biopsie) en met referentiemateriaal. Therapie-relevante mutaties (BRAF, EGFR, MET, KRAS, NRAS, PTEN, MEK, enz.) worden bepaald in het DNA van het tumorweefsel en, ter vergelijking, in het vrije circulerende DNA (cfDNA, celvrij DNA) en gecorreleerd met de resultaten van de genexpressieanalyse.
In het definitieve iQMedix-rapport wordt een compleet beeld verkregen van het individuele tumormetabolisme en daarmee aanwijzingen voor de geneesmiddeldoelen voor een optimale therapie. De expressieniveaus van de CTC’s maken ook het inschatten van de agressiviteit van de tumor mogelijk. CTC-mutatieanalyse onthult ook of er veel verschillende klonen zijn gevormd, wat de therapie bemoeilijkt.
In de genexpressieanalyse wordt de expressie of vorming van bepaalde receptoren die de tumor voor zijn doeleinden gebruikt, in kaart gebracht voor de overeenkomstige goedgekeurde geneesmiddelen. Als bijvoorbeeld topoisomerase II (TOPOIIA1) sterk tot expressie komt in vergelijking met niet-tumorweefsel, wordt geconcludeerd dat het gebruik van de juiste remmer (> anthracyclines) raadzaam is. Als de tumor in plaats daarvan topoisomerase I (TOPOI) gebruikt voor zijn groei, moet nu topotecan worden gebruikt als de overeenkomstige TOPOI-remmer. In dit geval zou het gebruik van anthracyclines ineffectief zijn, geassocieerd met ernstige bijwerkingen en de ontwikkeling van resistentie.
Dit kan dan alleen met zeer hoge kosten worden bestreden. Resistentie en bepaalde transportroutes die de tumor kan gebruiken om geneesmiddelen uit de cel te verwijderen, spelen een belangrijke rol. Medisch-moleculair biologische laboratoriumtests door middel van qPCR en mutatieanalyse voor de optimalisatie van een behandelbeslissing zijn in principe routinematig zowel in Duitsland als wereldwijd.
In de tumortherapie worden de vier bekendste biomarkers ERBB2/Her2neu (bijv. geneesmiddel Herzeptin: ja of nee), PGR, ER1 en KI67 routinematig geanalyseerd op genexpressie door immunohistochemie in bijna elke oncologiepraktijk en -kliniek. Bepaling van EGFR- en KRAS-mutaties enz. zijn verplicht voor het gebruik van bepaalde geneesmiddelen.
iQMedix heeft het panel van biomarkers of de bepaling van genexpressies uitgebreid tot meer dan 90 expressies. Hierdoor kan iQMedix geneesmiddeldoelen identificeren voor alle momenteel goedgekeurde geneesmiddelen voor de behandeling van vaste tumoren en op basis van deze informatie individuele therapiesuggesties doen. Dit stelt de arts in staat de therapie te richten, wat ook kosten bespaart. De procedure en de selectie van genexpressies zijn gebaseerd op klinische studies, die op verzoek graag worden gedeeld.
Afgezien van de vier eerdergenoemde markers, worden de meeste tumor geneesmiddelen momenteel gebruikt zonder geschikte testen, wat de relatief lage genezingsgraad en de verhoogde incidentie van metastasen en resistente cellen verklaart. De arts is genoodzaakt om verschillende therapieën uit te proberen op basis van trial-and-error. Dit brengt aanzienlijke bijwerkingen (toxiciteit) met zich mee voor de patiënten en aanzienlijke extra kosten, die vermeden kunnen worden.
Het analytische systeem van iQMedix kan vervolgens worden gebruikt om het succes van de therapie te monitoren.

De gegevens geven ook belangrijke informatie voor de lange termijn prognose met betrekking tot het optreden van recidieven en metastasen. Als de moleculair biologische analyses na chirurgische of radiotherapeutische verwijdering van de primaire tumor aantonen dat de agressiviteit van de tumor en de kans op terugkeer laag zijn, kan een lage dosis therapie worden gestart of, in individuele gevallen, kan medicatie helemaal achterwege worden gelaten. Dit vereist echter tweemaal per jaar monitoring.
De methode is ook geschikt voor tussentijdse monitoring en therapieaanpassing, bijv. als tumoren of metastasen operabel zijn gemaakt door individuele chemotherapie, maar residuen waarschijnlijk zijn op basis van moleculair biologische gegevens.
De kosten van de Metavectum Tumor Test worden meestal vergoed door de particuliere ziektekostenverzekering als de oncoloog hierom vraagt.
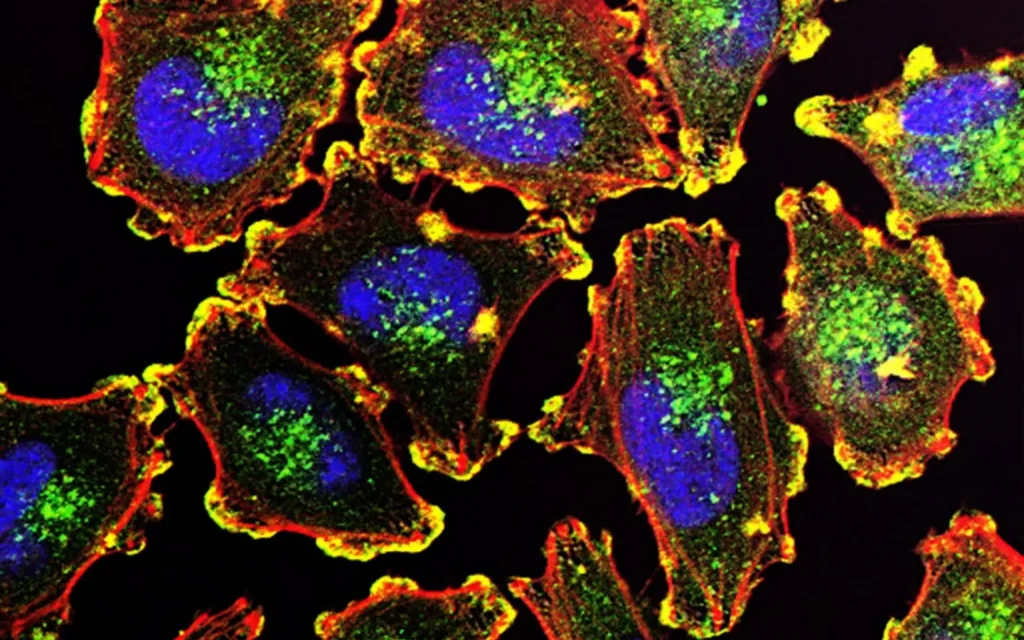
Circulerende tumorcellen (CTC)
Er zijn wereldwijd een aantal bedrijven die zich richten op circulerende tumorcellen en proberen medisch bruikbare resultaten te verkrijgen uit hun analyse. Het merendeel van deze bedrijven kwantificeert simpelweg CTC’s voor en na chemotherapie, vanuit het oogpunt dat een vermindering detecteerbaar zou moeten zijn als de therapie succesvol is.
In recente studies is echter aangetoond dat het aantal CTC’s in de tijd fluctueert: CTC’s zijn niet gelijk verdeeld over alle bloedvaten van het lichaam, CTC’s worden aangevuld vanuit epitheliaal weefsel en beenmerg, CTC’s desintegreren door intravasatie en extravasatie, EMT-overgangen wijzigen de CTC-barcode die wordt gebruikt voor identificatie, het immuunsysteem vernietigt CTC’s in de bloedbaan volgens activiteit, CTC’s voegen samen tot clusters.
Dit maakt duidelijk dat het omgaan met circulerende tumorcellen een complex veld is en vereist een uitgebreide periferie van apparatuur en methoden om tot een medisch bruikbare bevinding voor de therapeut te komen.
De moeilijkheden bij het omgaan met CTC’s kunnen goed worden geïllustreerd door een grafiek uit een review gepubliceerd in 2013 [Lit: Bin Hong et al.; Theranostics 2013, Vol. 3, p 377-394]. De afbeelding toont het voorkomen en de ontwikkeling van CTC’s in de bloedvaten en in het lichaam tot aan de metastasen.
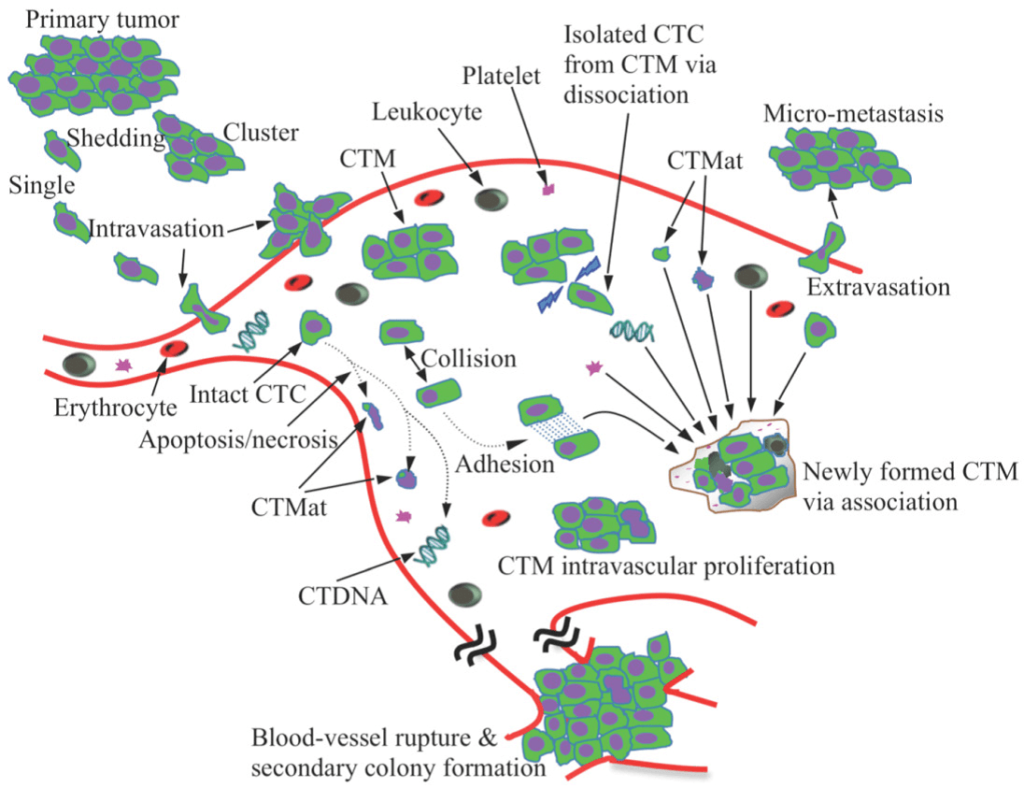
De primaire tumor geeft enkele cellen en clusters af die de bloedbaan binnengaan onder EMT (epitheel-mesenchymale overgang) verbindingen. Daar wordt het merendeel van de CTC’s in apoptose en necrose gedreven, hetzij door pre-schade aan de celstructuur tijdens het loskomen van de primaire tumor of tijdens invasie in de bloedvaten of door het immuunsysteem. Tijdens apoptose worden de celinhouden vrijgegeven (CTMat = circulerend tumormateriaal, CTDNA = circulerend tumor-DNA), waaronder stoffen met een laag moleculair gewicht, eiwitten en DNA.
Overlevende CTC’s kunnen nu de bloedbaan weer verlaten en metastasen vestigen op een geschikte locatie of ze associëren in de bloedbaan tot clusters (CTM). Deze clusters fungeren als conglomeraten die andere bloedcomponenten integreren, zoals erytrocyten en leukocyten, en bevatten ook het bovengenoemde CTDNA en CTMat. Deze celclusters (CTM’s) worden verder getransporteerd door de bloedbaan, vestigen zich in haarvaten vanwege hun grootte en vormen daar micrometastasen en later metastasen.
Dit toont aan dat bepaalde technieken en methoden essentieel zijn voor het onderzoek naar CTC’s en hun derivaten om tot een medisch relevante conclusie te komen. Deze omvatten:
· Mutatieanalyse in het genoom
· Genexpressie-analyse in het transcriptoom
· Eiwitkwalificatie en -kwantificering in het proteoom
· Analyse van laagmoleculaire stoffen (aminozuren, enz.) in het metaboloom Immunohistochemie op individuele CTC’s
Om de keten van primaire tumor, CTC, secundaire producten en metastasen vanuit het oogpunt van een therapeutisch relevante uitspraak te analyseren, koppelt iQMedix informatie uit het genoom, het transcriptoom, het proteoom en het metaboloom, aangezien deze vier niveaus elkaar wederzijds beïnvloeden.
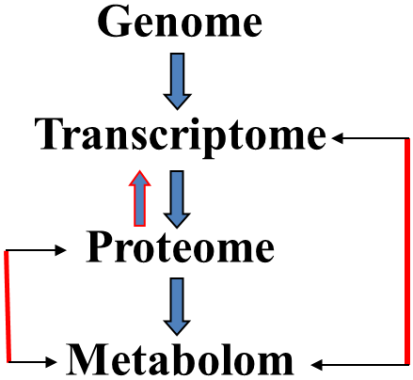
Dit betekent ook dat de individuele niveaus (genoom, proteoom, metaboloom) in staat zijn om werkopdrachten of informatie van een ander niveau te negeren, te blokkeren of zelfs om te keren. Bijvoorbeeld, de werkopdracht die in het transcriptoom aankomt om apoptose van een cel op te wekken, wordt soms op het proteoomniveau omgekeerd naar het tegenovergestelde.
Om deze redenen is het nodig om naar alle niveaus te kijken als er geldige conclusies moeten worden getrokken.
Dit onderzoek wordt in Duitsland door de zorgverzekering vergoed. In Nederland niet.

